Graduação Injeção Eletrônica Note on Relação ar-combustível, created by Tecnologias Automotivas on 15/02/2018.
|
|
Created by Tecnologias Automotivas
over 7 years ago
|
|




 (0)
(0)
| 0 | ||
| 0 | ||
| 0 | ||
| 0 | ||
| 0 |
0 comments
There are no comments, be the first and leave one below:
RELAÇÃO AR-COMBUSTÍVEL (AFR)
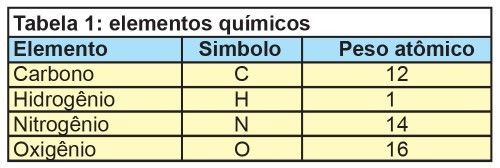
Pela tabela 1 podemos calcular a massa molecular de cada uma das partes: combustível = 12 do carbono + 4*1 do hidrogênio = 16g/mol
ar = 2*(16 do oxigênio*2 + 3,76*14 do nitrogênio*2) = 274,56g/mol
Divindo agora a massa de ar pela massa de combustível, temos: 274,56/16 = 17,16g/g
Isso significa que necessitamos de 17,16g de ar para queimarmos 1g de metano numa reação estequiométrica.
Cada combustível possui a sua relação ar- combustível teórica. Alguns exemplos podem ser verificados na tabela 3.
Onde isso pode nos ser útil?
Se AFR = mar/mcomb, podemos dizer que a massa de combustível pode ser calculada a partir do conhecimento do combustível que está no reservatório (AFR) e pela medição da quantidade de ar que está sendo admitida.
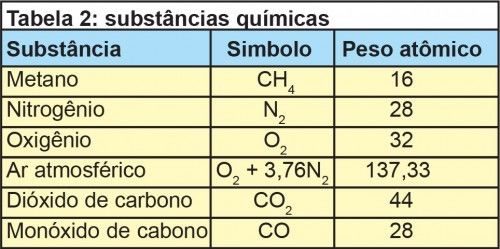
É exatamente deste estudo que vai nos facilitar o entendimento dos motores flex e também a necessidade de possuirmos sensores de pressão absoluta, temperatura do ar, medidores de massa de ar ou de fluxo de ar, etc.
MISTURA POBRE
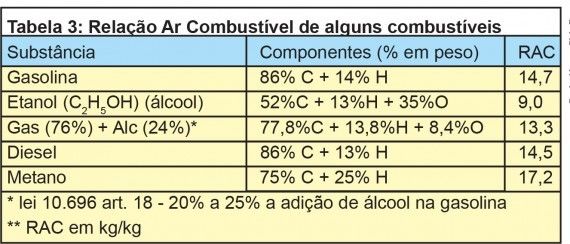
Continuando os nossos estudos, multipliquemos a equação da reação do metano por 10. Ou seja:
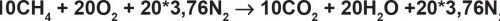
Agora admitamos a possibilidade de termos 22 moles de oxigênio e não 20 como nos exige a relação teórica ideal:

A relação ar-combustível nessa situação ficou com o seguinte resultado:
AFR = 22*137,33/10*16 AFR = 18,88
Perceba ainda a presença de oxigênio nos produtos (O2).
MISTURA RICA
Admitamos agora uma quantidade menor de oxigênio. Por exemplo, 18 moles:

Recalculemos o AFR. AFR = 18*137,33/10*16 AFR = 15,45
Além do AFR desta mistura ser menor do que o AFR da mistura estequiométrica, você percebeu a presença de monóxido de carbono (CO) no resultado da nossa queima?
Recalculemos o AFR. AFR = 18*137,33/10*16 AFR = 15,45
Além do AFR desta mistura ser menor do que o AFR da mistura estequiométrica, você percebeu a presença de monóxido de carbono (CO) no resultado da nossa queima?
